植物はGA内生量が変動するとフィードバック制御を発動させGA内生量を一定に維持しようとする。例えばGA生合成阻害剤を用いてGA内生量を人為的に低下させると、GA生合成反応の終盤を触媒するGA 20-酸化酵素とGA 3-酸化酵素の発現が転写レベルで上昇する。GA生合成はGA信号伝達系により制御されているのである。植物ホルモン研究の大きな二つの流れは内生量制御の解析と信号伝達系の解析である。我々はGAフィードバック制御を二つの研究局面の接点と捉え、分子レベルの解析を行っている。RSG は GA 内生量が低下した時、タバコの GA 20-酸化酵素遺伝子 NtGA20ox1 に直接結合しフィードバック制御に関与す。この時、NtGA20ox1 プロモーターのヒストンコードが変化することが明らかになった (Plant J, 2010)。

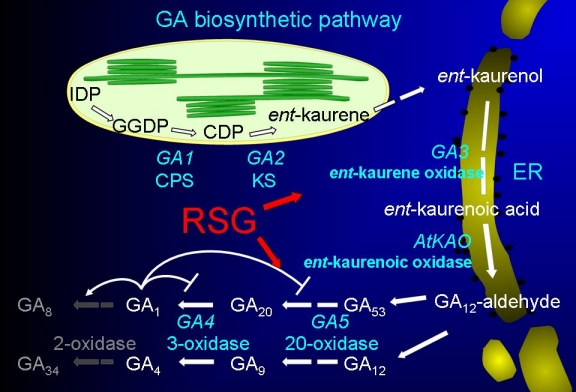
転写因子RSGの機能阻害により矮化したタバコ(左)と GA 生合成経路(右).
遺伝子の秩序正しい発現調節には転写因子間の相互作用が重要である。RSG を中心とした転写調節系がいかにして発生のプログラムと環境情報を統合し、ジベレリンの内生量を調節しているかを明らかにするため、bZIP 型転写因子 RSG と相互作用するタンパク質群を単離し解析している。そのうちの一つのグループは、14-3-3 と呼ばれる真核生物に広く存在する制御因子であった。14-3-3 はリン酸化セリン/トレオニンを中心とするモチーフを認識して標的タンパク質と結合する。 14-3-3 は転写活性化因子 RSG を負に調節しており(PLANT CELL, 2001)、その機能調節の実体は RSG の細胞内局在制御である事を見出した。すなわち発生のプログラム、環境刺激は RSG と 14-3-3 の結合を制御することで、 RSG の機能ひいてはジベレリン内生量を制御していると考えられる. この研究は注目を集め PLANT CELL 誌の IN THIS ISSUE で紹介され 、Faculty of 1000 Biology にも選出された。
RSG の細胞内局在に影響を与える要因を探索したところ、RSG の細胞内局在は GA の内生量によって制御されることが明らかになった。GA の内生量が低下すると RSG は核に蓄積し、GA を投与すると RSG は細胞質に移行した。この結果は RSG が GA フィードバック制御に関与することを示唆している(PLANT CELL, 2004)。実際、RSG の機能を抑制すると GA20ox(GA 20-酸化酵素)遺伝子のフィードバック制御が阻害された。
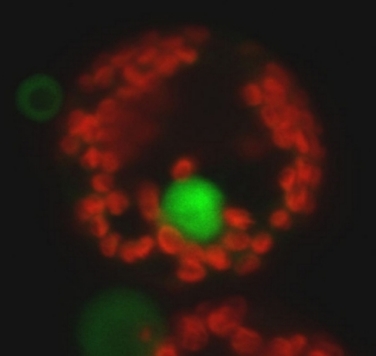
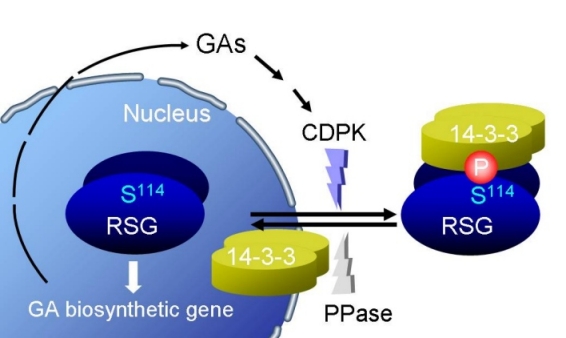
S114A 変異型 RSG の核への局在(左)、CDPK と 14-3-3 による RSG の機能調節機構のモデル(右).

RSG と 14-3-3 の結合は、RSG の 114 番目の Ser 残基のリン酸化によって制御されている。したがって 114 番目の Ser 残基をリン酸化するキナーゼは RSG と 14-3-3 の結合、ひいては RSG の細胞内局在を制御する。我々は RSG キナーゼの実体が CDPK(カルシウム依存性タンパク質キナーゼ)の一つであることを明らかにした(PLANT CELL, 2008)。なお、この論文は Faculty of 1000 Biology に選出された。GA は CDPK を介して RSG の機能を制御しているのである。
Ca依存性タンパク質キナーゼNtCDPK1がいかにして基質である転写因子RSGを認識するかを解析したところ、N末の非保存領域が重要であることが明らかになった。さらにRSGを基質としないAtCPK9のN末非保存領域をNtCDPK1のそれと置き換えるとRSGキナーゼの機能を獲得した(PLANT CELL, 2010) 。この知見はN末の非保存領域の改変より、キナーゼの基質特異性を操作することが可能であり、さらに新たな信号伝達経路創出の可能性を示唆している。
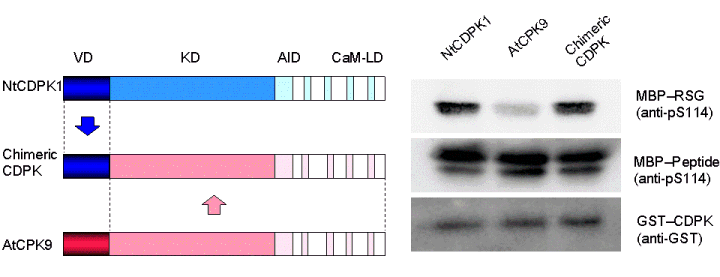
N末の非保存領域の改変よるキナーゼの基質特異性の操作.
NtCDPK1はRSGだけでなく14-3-3とも結合し、三者複合体を形成することが示された。三者複合体を形成させた状態でリン酸化反応を行うと、RSGと14-3-3はNtCDPK1から解離し、解離したRSGには14-3-3が結合していることが示された。 リン酸化されたRSGはリン酸化されていないRSGに比べてNtCDPK1に結合しにくいこと、また14-3-3は自己リン酸化されたNtCDPK1よりもリン酸化されたRSGとの親和性が高いことが示された。 したがって、RSGはリン酸化されるとNtCDPK1から解離し、そのとき14-3-3はNtCDPK1からより親和性の高いRSGに受け渡されると考えられた。 これらの結果から、NtCDPK1はRSGキナーゼの活性を持つだけでなく、14-3-3とRSGの結合を促進するスキャフォールドとしても機能すると考えられた(PLANT PHYSIOL, 2014)。
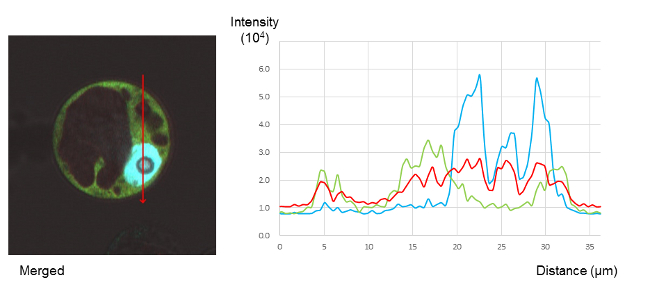
RSG, NtCDPK1, 14-3-3 は細胞内で三者複合体を形成している。共焦点レーザー顕微鏡による観察。

GA信号伝達のスイッチであるDELLAタンパク質は、GA信号伝達の負の制御因子として同定された。GA刺激を受けるとDELLAが分解され、細胞がGAに応答する。これまでGAによる転写制御は、DELLAの分解により転写活性化因子の抑制が解除されるモデルで説明されてきた。 しかしこのモデルではGA生合成酵素遺伝子のフィードバック制御の分子機構を説明出来なかった。我々はDELLAと相互作用する新しい転写因子GAF1を同定した。DELLAはGAF1のコアクティベーターとして転写を促進することを見出した。 さらにGAF1-DELLA転写活性化複合体はGA刺激を受けるとGAF1-TPR転写抑制複合体に機能転換することを明らかにした(PLANT CELL, 2014)。これらの結果は従来のGAによる転写制御モデルの問題を解決するものである。 すなわちDELLAはタイトレーションとコアクティベーションの二つの機能でGAに関連した二つの遺伝子群の一方をOFFに、他方をONに、同時に統括制御しているのである。本研究はRIKEN RESEARCH で紹介された。
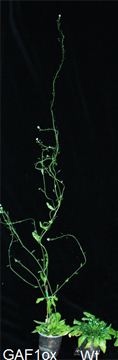
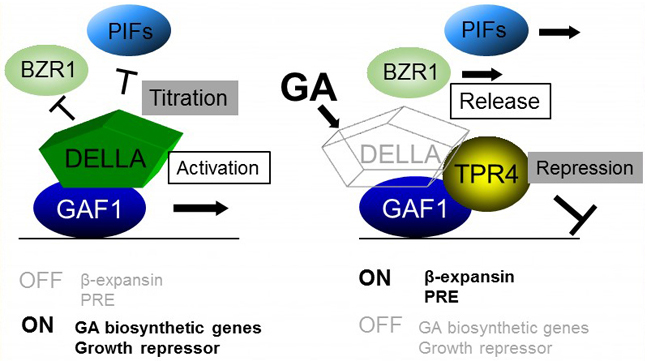
GAF1過剰発現体の形態(左図)。GAF1による転写制御モデル(右図)。

いつ花を咲かせるかは、植物にとって最も重要な決定の1つである。栄養成長から生殖成長への移行は花成と呼ばれ、主に4つの花成経路(自律経路、春化経路、光周期経路、GA経路)が知られている。 これらの経路は、冗長的で、最終的に、花成統合遺伝子FT, SOC1, LFYに集約されることが報告されている。GA花成経路では、GA依存的に花成統合遺伝子FT, SOC1, LFYの発現が誘導され花成が促進されるが、 GAによる花成統合遺伝子の発現制御に関しては未解明の部分が多く存在した。これまでに、GA信号伝達における抑制因子DELLAと相互作用するGAF1転写因子を発見し解析を行ってきた。 形質転換植物体を用いた解析より、短日条件下においてGAF1過剰発現体は花成が促進され、gaf1 idd1変異体は花成が著しく遅延したことから、GAF1のGA花成経路への関与が示唆された。 RNA-seq解析等からGAF1の新たな標的遺伝子として花成抑制遺伝子ELF3, TEM1, TEM2, SVPを同定した。葉で、ELF3, TEM1, SVP、茎頂でSVPが発現しており、FT, SOC1の発現を抑制しており、 GA花成経路では、GA依存的にGAF1-TPR転写抑制複合体が形成され、これらの花成抑制遺伝子の発現を抑制することで、FT, SOC1の発現抑制が解除され花成が促進されることが明らかとなった(PLANT CELL, 2021)。
GAF1過剰発現体、gaf1 idd1 変異体の表現型(左図)。GAF1複合体を介したGA花成経路の制御モデル(右図)。
Fukazawa,J., Mori, K., Ando, H., Mori, R., Kanno, Y., Seo, M., and Takahashi, Y. (2023) Jasmonate inhibits plant growth and reduces gibberellin levels via microRNA5998 and transcription factor MYC2 in Arabidopsis. Plant Physiol., 193, 2197-2214.
Fukazawa, J. Miyamoto, C., Ando, H., Mori, K. and Takahashi, Y. (2021) DELLA-GAF1 complex is involved in tissue-specific expression and gibberellin feedback regulation of GA20ox1 in Arabidopsis. Plant Mol. Biol.107, 147-158.
Fukazawa, J. Ohashi, Y., Takahashi, R., Nakai, K. and Takahashi, Y. (2021) DELLA degradation by gibberellin promotes flowering via GAF1-TPR-dependent repression of floral repressors in Arabidopsis. Plant Cell 33, 2258-2272.
Ito, T., Ishida, S. and Takahashi, Y. (2018) Autophosphorylation of Ser-6 via an intermolecular mechanism is important for the rapid reduction of NtCDPK1 kinase activity for substrate RSG. PLOS ONE, e0196357.
Okada, K., Ito, T., Fukazawa, J. and Takahashi, Y. (2017) Gibberellin induces an increase in cytosolic Ca2+ via a DELLA-independent signaling pathway. Plant Physiol. 175, 1536-1542.
Fukazawa, J., Mori, M., Watanabe, S., Miyamoto, C., Ito, T. and Takahashi, Y. (2017) DELLA-GAF1 complex is a main component in gibberellin feedback regulation of GA 20-oxidase 2. Plant Physiol. 175, 1395-1406.
Ito, T., Ishida, S., Oe, S., Fukazawa, J. and Takahashi, Y. (2017) Autophosphorylation affects substrate-binding affinity of tobacco Ca2+-dependent protein kinase1. Plant Physiol. 174, 2457-2468.
Fukazawa, J., Ito, T., Kamiya, Y., Yamaguchi, S. and Takahashi, Y. (2015) Binding of GID1 to DELLAs promotes dissociation of GAF1 from DELLA in GA dependent manner. Plant Signal Behav. 10, e1052923.
Ito, T., Nakata, M., Fukazawa, J., Ishida, S. and Takahashi, Y. (2014) Phosphorylation-independent binding of 14-3-3 to NtCDPK1 by a new mode. Plant Signal Behav. 9, e977721.
Fukazawa, J., Teramura, H., Murakoshi, S., Nasuno, K., Nishida, N., Ito, T., Yoshida, M., Kamiya, Y., Yamaguchi, S., and Takahashi, Y. (2014) DELLAs function as coactivators of GAI ASSOCIATED FACTOR1 in regulation of GA homeostasis and signaling in Arabidopsis. Plant Cell 26, 2920-2938.
Ito, T., Nakata, M., Fukazawa, J., Ishida, S. and Takahashi, Y. (2014) Scaffold function of Ca2+-dependent protein kinase: NtCDPK1 transfers 14-3-3 to the substrate RSG after phosphorylation. Plant Physiol. 165, 1737-1750.
Ito, T., Nakata, M., Fukazawa, J., Ishida, S. and Takahashi, Y. (2010) Alteration of substrate specificity: The variable N-terminal domain of Ca2+-dependent protein kinase is important for the substrate recognition. Plant Cell 22, 1592-1604.
Fukazawa, J., Nakata, M., Ito, T., Yamaguchi, S. and Takahashi, Y. (2010) The transcription factor RSG regulates negative feedback of NtGA20ox1 encoding GA 20-oxidase. Plant J. 62, 1035-1045.
Ishida, S., Yuasa, T., Nakata, M. and Takahashi, Y. (2008) A tobacco calcium-dependent protein kinase, CDPK1, regulates the transcription factor REPRESSION OF SHOOT GROWTH in response to gibberellins. Plant Cell 20, 3273-3288.
Nagae, M., Nakata, M. and Takahashi, Y. (2008) Identification of negative cis-acting elements in response to copper in the chloroplastic iron superoxide dismutase gene of the moss Barbula unguiculata. Plant Physiol. 146, 1687-1692.
Matsushita, A., Furumoto, T., Ishida, S. and Takahashi. Y. (2007) AGF1, an AT-Hook protein, is necessary for the negative feedback of AtGA3ox1 encoding GA 3-oxidase. Plant Physiol. 143, 1152-1162.
Ishida, S., Fukazawa, J., Yuasa, T. and Takahashi, Y. (2004) Involvement of 14-3-3 signaling protein binding in the functional regulation of transcriptional activator RSG by gibberellins. Plant Cell 16, 2641-2651.
Takahashi Y., Fukazawa, J., Matushita A. and Ishida, S. (2003) Involvement of RSG and 14-3-3 proteins in the transcriptional regulation of a GA biosynthetic gene. J. Plant Growth Regul. 22, 195-204.
Igarashi, D., Ishida, S., Fukazawa, J. and Takahashi, Y. (2001) 14-3-3 proteins regulate intracellular localization of the bZIP transcriptional activator RSG. Plant Cell 13, 2483-2497.
Fukazawa, J., Sakai, T., Ishida, S., Yamaguchi, I., Kamiya, Y. and Takahashi, Y. (2000) REPRESSION OF SHOOT GROWTH, a bZIP transcriptional activator, regulates cell elongation through the level of gibberellins. Plant Cell 12, 901-915.
 総説
総説
Ito, T., Okada, K., Fukazawa, J. and Takahashi, Y. (2018) New gibberellin signaling pathway via Ca2+ signaling. Atlas of Science
Ito, T., Okada, K., Fukazawa, J. and Takahashi, Y. (2018) DELLA-dependent and -independent gibberellin signaling. Plant Signal Behav. 13, e1445933.
Ito, T. and Takahashi, Y. (2015) Phosphatase protection assay: 14-3-3 binding protects the phosphate group of RSG from λ protein phosphatase. Bio-Protocol 5, e1395.
Ito, T., Nakata, M., Ishida, S. and Takahashi, Y. (2011) The mechanism of substrate recognition of Ca2+-dependent protein kinases. Plant Signal Behav. 6, 924 - 926.
Takahashi, Y. and Ito, T. (2011) Structure and function of CDPK: A sensor responder of calcium. In Coding and Decoding Calcium Signals in Plants S. Luan, ed., Signaling and Communication in Plants 10, 129-146, Berlin: Springer-Verlag. DOI: 10.1007/978-3-642-20829-4_9.
Fukazawa, J., Nakata, M., Ito, T., Matushita, A., Yamaguchi, S. and Takahashi, Y. (2011) bZIP transcription factor RSG controls the feedback regulation of NtGA20ox1 via intracellular localization and epigenetic mechanism. Plant Signal Behav. 6, 26-28.
渡邊哲史,石田さらみ,高橋陽介 (2010) ジベレリン応答における遺伝子発現制御 植物におけるシグナル伝達−分子と応答− 共立出版
Nakata, M., Yuasa, T., Takahashi, Y. and Ishida, S. (2009) CDPK1, a calcium-dependent protein kinase, regulates transcriptional activator RSG in response to gibberellins. Plant Signal Behav. 4, 372-374.
石田さらみ,高橋陽介 (2005) ジベレリンによる転写調節因子の機能制御 生物物理 45, 264-267.
石田さらみ、高橋陽介 (2002) 茎の形成、植物の形づくり 蛋白質核酸酵素 47, 1581-1586 共立出版
高橋陽介 (2001) 植物ホルモン応答にかかわる転写因子(オーキシン,サイトカイニン,ブラシノステロイド) 植物ゲノム機能のダイナミズム 岩渕雅樹,篠崎一雄 編 シュプリンガー・フェアラーク東京 123-134.
桜井英博,柴岡弘郎, 高橋陽介, 小関良宏, 藤田知道 (2017) 植物生理学概論改訂版 培風館,東京
桜井英博,柴岡弘郎,芦原坦,高橋陽介 (2008) 植物生理学概論 培風館,東京
桜井英博,柴岡弘郎,芦原坦,高橋陽介 (2001) 植物生理学入門三訂版 培風館,東京
 翻訳
翻訳Taiz and Zeiger Plant Physiology 3rd ed. ジベレリン−植物の背丈の制御−高橋陽介(2004)培風館,東京

(高橋 への連絡先E-mail:ytakahas@*) @*以下はhiroshima-u.ac.jp